AI +蛋白质市场规模及应用场景
2024 年诺贝尔化学奖授予戴维-贝克(David Baker)、戴米斯-哈萨比斯(Demis Hassabis)和约翰-朱伯(John M. Jumper),以表彰他们在蛋白质设计和结构预测领域做出的杰出贡献。DeepMind 团队的 AlphaFold3 凭借其强大的结构预测统一框架,为药物开发开辟了新的可能性,并有可能颠覆当前的药物发现模式。
目前,对蛋白质的人工智能开发主要集中在预测蛋白质本身的结构和功能,预测蛋白质与其他生物大分子的相互作用,以及蛋白质设计和蛋白质组学分析等方面。在工业应用中,“人工智能+蛋白质设计 ”所占比例最高。目前,这些预测技术已更多地嵌入到现有的药物开发和蛋白质工程流程中。
根据 MedMarket Insights 的数据,人工智能蛋白质市场规模在 2023 年达到 14.83 亿美元,预计到 2031 年将增长到 178 亿美元,复合年增长率约为 36.5%,这主要得益于人工智能宏模型对生命科学的高度适应性。
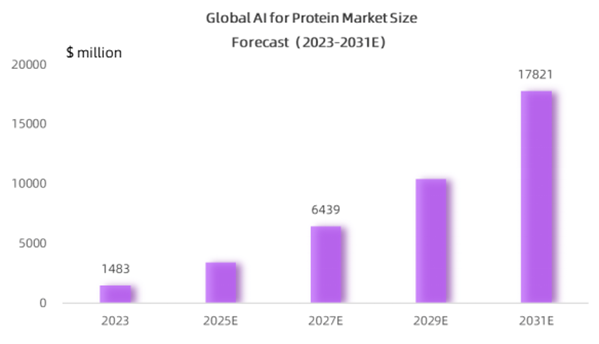
数据来源: MedMarket Insights, 2023
从全球市场来看,美国是全球人工智能蛋白质研究和应用的领导者,约占市场份额的 58%。欧洲占 22%,亚洲(主要是中国和一些日本公司)约占 12% 的市场份额,英国和中东分别占 4% 和 2%,其他地区占 2%。
全球蛋白质人工智能市场分布预测
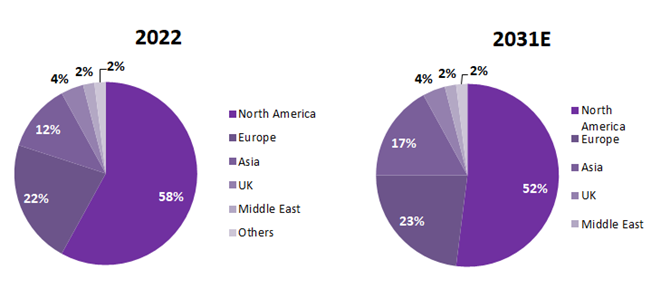
数据来源: MedMarket Insights, 2023
人工智能+蛋白质应用场景
随着以深度学习为代表的人工智能(AI)技术的发展,为蛋白质研究提供了另一种思路,带来了方法、流程和思维的创新。特别是以 AlphaFold 为代表的突破性创新,人工智能在蛋白质结构预测、优化设计和组学研究方面取得了重大进展。同时,这些技术已经从实验室走向实际应用,覆盖了蛋白质设计、药物发现、合成生物学等多个领域。
1、蛋白质设计
人工智能蛋白质设计可分为两个主要方向:蛋白质优化和蛋白质从头设计。
从功能到序列的蛋白质设计只需要确定能实现该功能的氨基酸序列。蛋白质优化涉及修改天然序列(定向进化)以增强其特定功能,如增强亲和力、提高催化活性和稳定性。从零开始的蛋白质设计,包括从结构设计序列、从功能设计序列和从功能设计结构,这也是 David Baker 教授及其团队特别成功的领域。
2、药物发现
人工智能蛋白质预测和蛋白质设计可以大大加快新药研发的进程。通过预测蛋白质的结构和功能,模拟蛋白质与其他生物大分子的相互作用过程,可以准确确定药物与靶点的结合位点,为药物研发提供有力支持。此外,基于人工智能的端到端蛋白质设计技术可以实现从无到有,设计出具有特定功能的蛋白质类药物。同时,将人工智能与蛋白质组学数据相结合,可以系统分析人体内蛋白质、疾病和药物之间的关联,补充靶点库,加速药物研发进程。
约 85% 的人类疾病相关蛋白质靶点难以成为药物,因为有些蛋白质难以分析和观察,即使使用电子显微镜和核磁共振等传统方法,也只能观察到其静态结构。AI技术为药物发现和开发提供了新的工具和方法,以解决难以成药的靶点,有望改变传统的药物发现模式,提高药物发现的效率和成功率。
3、合成生物学
在合成生物学领域,通过精确控制和改变蛋白质的结构和功能,为农业、食品和制药业提供了创新解决方案。这具有巨大的应用潜力和经济价值。
在农业领域,人工智能可以改良作物蛋白质,提高产量和质量,减少环境污染。2021 年,NotCo 公司推出了人工智能平台 Giuseppe,利用人工智能设计和预测植物性蛋白质的结构,模仿动物性食品中的营养成分和口感,为植物性食品的开发提供优化建议。
在食品领域,人工智能可以帮助开发营养更丰富、成本更低廉的优质蛋白质。合成生物学公司 Arzeda 在酶改性领域取得了重大成果,利用其先进的酶改性平台开发出了可高效转化甜味剂并降低生产成本的酶。此外,Arzeda 还为英国石油公司开发了新型酶,以提高石油开采和生产过程的效率。
如何将设计的蛋白质转化为“实际功能蛋白质”?
1.设计蛋白质
功能位点鉴定: 第一步是确定蛋白质的功能位点,该位点负责蛋白质的生化活性。
序列设计: 研究人员利用深度学习算法设计氨基酸序列,使其能折叠成包含所需功能位点的三维(3D)结构。这一步尤其具有挑战性,因为它需要创建一个具有功能区(如活性位点或结合界面)的稳定的整体支架,并设计一个可折叠成该结构的序列。
2. 验证和优化
性能验证: 在进行实验之前,要对设计的蛋白质进行计算验证。这包括检查蛋白质的稳定性,确保功能位点位置正确,并预测其与其他分子的相互作用。
优化: 在计算验证的基础上,设计可能会经过几轮优化,以提高其稳定性、功能性和在生物系统中的表达。
3. 合成与表达
基因合成: 获得优化的蛋白质序列后,下一步就是合成相应的基因。这可以通过 DNA 合成技术来完成,目前这种技术已经高度自动化,而且效率很高。
蛋白表达: 然后将合成的基因克隆到合适的宿主细胞(如细菌、酵母或哺乳动物细胞)中进行蛋白质表达。在最佳条件下培养宿主细胞,以促进所需蛋白质的高水平表达。
4. 纯化和表征
蛋白纯化: 表达后,利用各种生化技术(如层析和电泳)从宿主细胞中纯化蛋白质。这一步骤可确保蛋白质不含污染物和杂质。
表征分析: 然后使用光谱、电泳和质谱等各种生物化学和生物物理方法对纯化的蛋白质进行表征。这些方法可提供有关蛋白质结构、稳定性和功能特性的信息。
5. 蛋白功能测试
通过使用特定的检测方法来测试蛋白质的功能特性,以测量其活性或与目标分子的结合亲和力。这些检测方法包括酶活性测量、结合实验或细胞检测。
泓迅生物——让人工智能设计的蛋白质“活”起来
泓迅生物结合人工智能设计和合成生物学的力量,提供从蛋白质序列优化、表达到功能验证的全面支持,促进蛋白质预测的下游应用研究,让人工智能设计的蛋白质“活”起来。
Syno GS 平台:AI-Drivern 深度 DNA 合成
Syno GS 平台拥有多种智能生物分析工具,包括 Syno Ab、NG Codon、Complexity Index (CI) 和 AI-TAT。您只需提供想要合成的核苷酸或氨基酸序列,我们就会提供 100% 精确的基因序列,并克隆到您指定的载体中。精确的基因序列可以提高蛋白质表达的准确性和效率。
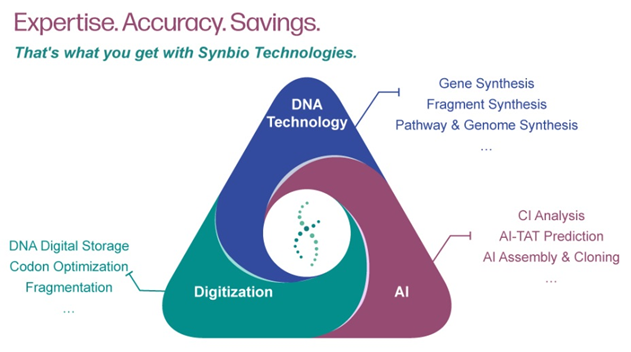
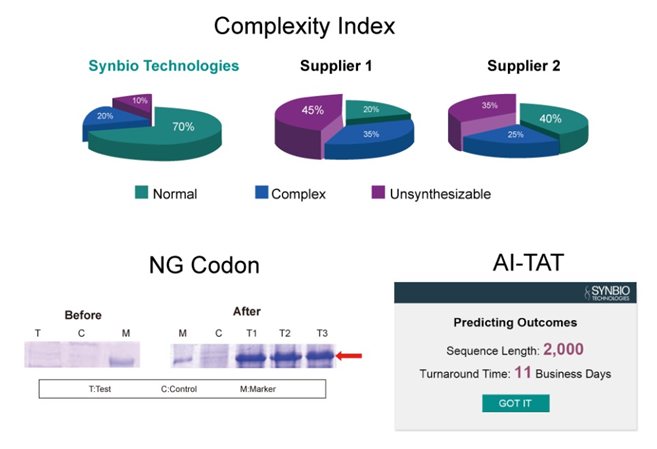
AI 驱动器深度 DNA 合成
Syno 蛋白平台:实现从序列到结构再到功能的转变
泓迅生物提供细菌、酵母、昆虫和哺乳动物四种蛋白质表达系统选择。从毫克到克,我们的合成生物学平台和 NG Condon 优化技术可生产出高纯度的活性蛋白质,加速您的研究。根据蛋白质的性质和客户的具体要求,我们从一系列表达载体、表达宿主和融合标签中精心挑选,以提供最佳结果。我们为世界各地的科学家提供定制服务。
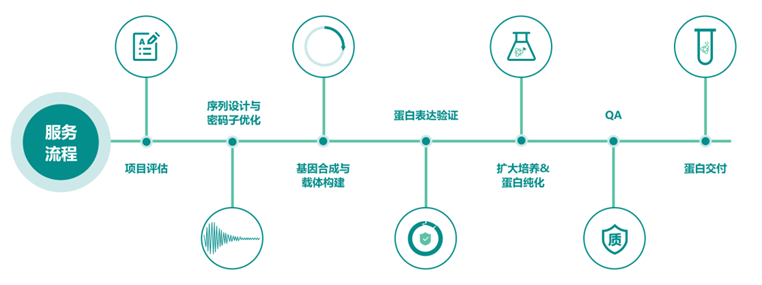
蛋白表达服务流程
Syno Ab 平台:助力抗体发现
AlphaFold 擅长预测蛋白质结构,但无法模拟蛋白质与其他蛋白质或药物分子相互作用时的变化。泓迅生物的 Syno Ab 抗体平台以 AlphaFold 预测的抗原结构为起点,解决了这一局限性。它以抗体生物医学生物计算为支撑,有效模拟抗原-抗体对接,将计算技术与实验方法相结合,帮助研究人员大幅降低抗体开发的总体成本,缩短开发周期。
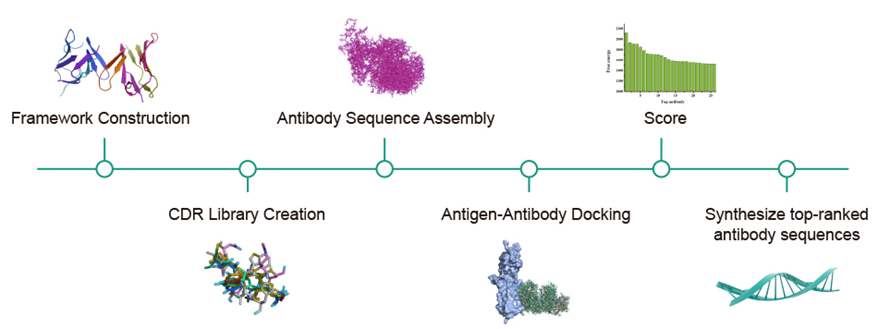
服务流程
References
1.ABRAMSON, Josh, et al. Accurate structure prediction of biomolecular interactions with AlphaFold 3.Nature, 2024, 1-3.
2.CHEN, Lingtao, et al. AI-Driven Deep Learning Techniques in Protein Structure Prediction.International journal of molecular sciences, 2024, 25.15: 8426.
3. GOEL, Divya; KUMAR, Ravi; KUMAR, Sudhir. AI-Assisted Methods for Protein Structure Prediction and Analysis. In:Microbial Data Intelligence and Computational Techniques for Sustainable Computing. Singapore: Springer Nature Singapore, 2024. p. 365-391.
4. Yoshida Hiroyuki,[Deep Learning and AlphaGo].[J] .Brain Nerve, 2019, 71: 681-694.
5. Niazi Sarfaraz K,Molecular Biosimilarity-An AI-Driven Paradigm Shift.[J] .Int J Mol Sci, 2022, 23.
6. Liu Z, Zhang Y, Nielsen J. Synthetic biology of yeast[J]. Biochemistry, 2019, 58(11): 1511-1520.
(来源:当代健康)


